
電話:
021-67610176傳真:
本文轉(zhuǎn)載自“藥明康德”。
在癌癥免疫療法領(lǐng)域,免疫檢查點(diǎn)抑制劑和CAR-T療法無疑是改變癌癥治療模式的兩大突破。然而,免疫檢查點(diǎn)抑制劑已經(jīng)可以用于治療多種癌癥類型,而CAR-T療法的適應(yīng)癥卻。CAR-T療法雖然在治療B細(xì)胞血液癌癥方面表現(xiàn)出的療效,然而治療其它類型癌癥的CAR-T療法還遲遲未能誕生。
究其根源,CAR-T療法的設(shè)計(jì)和開發(fā)需要克服三大挑戰(zhàn):缺少理想的腫瘤抗原作為靶點(diǎn),腫瘤介導(dǎo)的免疫抑制,和CAR-T療法的嚴(yán)重毒副作用。那么,用什么方法可以克服這三大挑戰(zhàn),提高CAR-T療法的效果并拓寬其應(yīng)用范圍呢?

日前,麻省理工學(xué)院(MIT)跨界學(xué)者盧冠達(dá)(Timothy Lu)博士在《Nature Reviews Cancer》上發(fā)表文章,介紹了使用合成生物學(xué)構(gòu)建新一代“智能”CAR-T療法的進(jìn)展。80后的盧冠達(dá)博士是MIT電子工程、計(jì)算機(jī)科學(xué)和生物工程系教授,也是Senti Biosciences、Tango Therapeutics和Synlogic等多家生物技術(shù)公司的創(chuàng)始人。今天,藥明康德微信團(tuán)隊(duì)將和讀者一起分享這篇文章中的精彩內(nèi)容。
使用基因回路讓兩種抗原控制CAR-T細(xì)胞的激活
CAR-T細(xì)胞療法首先從患者體內(nèi)收集T細(xì)胞,然后通過基因工程在T細(xì)胞表面表達(dá)嵌合抗原受體(CAR)。這是一種融合蛋白,它的細(xì)胞外蛋白域是一個(gè)識(shí)別腫瘤表面抗原的單鏈可變區(qū)片段(scFv),而細(xì)胞內(nèi)蛋白域包含了T細(xì)胞受體(TCR)和相關(guān)共刺激受體的細(xì)胞內(nèi)蛋白域。這些CAR-T細(xì)胞然后被輸回患者體內(nèi),它們可以識(shí)別和消滅表達(dá)抗原的腫瘤細(xì)胞。
目前,已有兩種CAR-T療法獲得FDA批準(zhǔn),它們?cè)谥委烞細(xì)胞血癌方面療效突出。然而,目前獲批的CAR-T療法都只能識(shí)別一種抗原。發(fā)現(xiàn)一個(gè)能夠特異性標(biāo)記腫瘤細(xì)胞的腫瘤表面抗原是一個(gè)巨大的挑戰(zhàn),這也是限制CAR-T療法廣泛應(yīng)用的原因之一。
例如,靶向CD19的CAR-T細(xì)胞能夠有效治療B細(xì)胞血癌,然而因?yàn)镃D19也表達(dá)在正常B細(xì)胞表面,這類療法也會(huì)消滅正常B細(xì)胞,從而導(dǎo)致B細(xì)胞發(fā)育不全。雖然靶向CD19的CAR-T療法的這一副作用通常不會(huì)致命,而且可以通過靜脈輸入免疫球蛋白來進(jìn)行治療,然而,在靶向其它抗原時(shí),患者可能無法耐受CAR-T細(xì)胞對(duì)正常細(xì)胞的殺傷。
合成化學(xué)力圖使用工程學(xué)的理論來改造活細(xì)胞,通過在細(xì)胞中加入基因電路(gene circuits),讓它們能夠感知外來信號(hào)并且作出簡單的邏輯決策。比如,在設(shè)計(jì)新一代CAR-T細(xì)胞方面,依靠多種抗原來區(qū)分腫瘤細(xì)胞和正常細(xì)胞,將可以讓CAR-T更為靶向腫瘤,并且更具有適應(yīng)性。
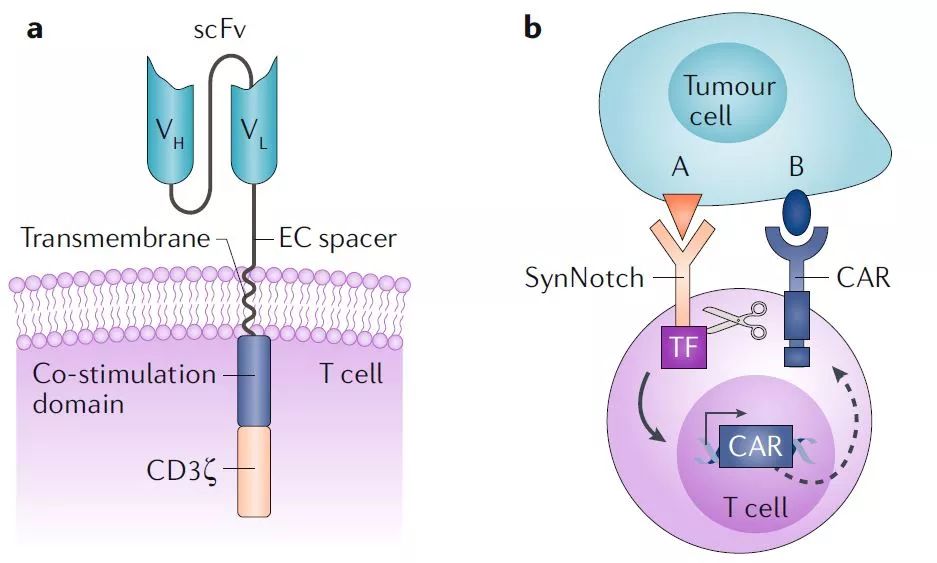
▲傳統(tǒng)CAR設(shè)計(jì)(a)和基于synNotch的CAR-T細(xì)胞設(shè)計(jì)(b),synNotch受體讓CAR-T細(xì)胞需要同時(shí)與抗原A和B結(jié)合才能被激活 (圖片來源:參考資料[1])
例如,合成生物學(xué)可以設(shè)計(jì)出一種T細(xì)胞,它必須識(shí)別腫瘤表面表達(dá)的兩種抗原才會(huì)被激活。這一設(shè)計(jì)可以通過人工合成的Notch受體(synNotch)來實(shí)現(xiàn)。synNotch受體在與腫瘤表面的特定抗原A結(jié)合后,通過釋放轉(zhuǎn)錄因子,能夠激發(fā)CAR-T細(xì)胞表達(dá)靶向第二個(gè)抗原B的CAR。在這種情況下,CAR-T細(xì)胞只有在接觸到抗原A,再接觸到抗原B的時(shí)候才會(huì)被激活。
這一synNotch技術(shù)初由加州大學(xué)舊金山分校的Wendell Lim博士率領(lǐng)的團(tuán)隊(duì)開發(fā),并且在動(dòng)物實(shí)驗(yàn)中得到驗(yàn)證。Lim博士共同創(chuàng)建了名為Cell Design Labs的公司來轉(zhuǎn)化這一技術(shù)。在2017年12月,吉利德科學(xué)旗下的Kite Pharmaceuticals公司以可高達(dá)5.67億美元的數(shù)額收購了Cell Design Labs,將這一技術(shù)納入該公司的CAR-T開發(fā)平臺(tái)。
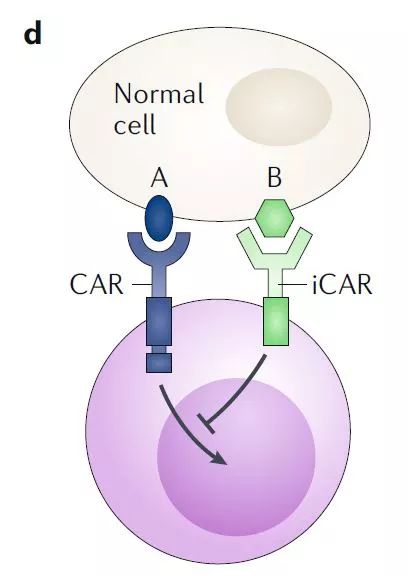
▲保護(hù)正常細(xì)胞不受CAR-T攻擊的CAR-T設(shè)計(jì)策略,正常細(xì)胞表面表達(dá)的抗原B會(huì)激活iCAR,從而抑制CAR-T細(xì)胞的激活(圖片來源:參考資料[1])
而在位于紐約的紀(jì)念斯隆-凱特琳癌癥中心(MSKCC),Michel Sadelain博士領(lǐng)導(dǎo)的團(tuán)隊(duì)設(shè)計(jì)出了同樣依靠兩種不同抗原的另一類CAR-T療法。這一設(shè)計(jì)利用在正常細(xì)胞表面表達(dá)的抗原,抑制CAR-T細(xì)胞的功能。在這種設(shè)計(jì)中,CAR-T細(xì)胞表面表達(dá)著兩種不同的CAR,一種是激活性CAR,它與腫瘤表面表達(dá)的特定抗原A的結(jié)合能夠激活T細(xì)胞。而另一種是抑制性CAR(iCAR),它將靶向正常細(xì)胞表面表達(dá)的抗原B的抗體與免疫檢查點(diǎn)蛋白CTLA-4或PD-1受體的細(xì)胞內(nèi)域融合在一起。這種iCAR在與抗原結(jié)合后能夠抑制T細(xì)胞的激活。當(dāng)表達(dá)兩種CAR的T細(xì)胞同時(shí)接觸到兩種抗原時(shí),抑制性CAR會(huì)抑制激活性CAR的作用。所以,這種CAR-T細(xì)胞只有在接觸到腫瘤特異性抗原A,但是不接觸到正常細(xì)胞中表達(dá)的自體抗原B時(shí)才會(huì)被激活。

▲雙特異性CAR-T細(xì)胞設(shè)計(jì),兩種不同的scFv片段可以識(shí)別腫瘤表面兩種不同的抗原,任何一種都可以激活CAR-T細(xì)胞(圖片來源:參考資料[1])
接受CAR-T療法治療的腫瘤會(huì)通過降低靶向抗原的表達(dá)來逃避CAR-T細(xì)胞的攻擊。例如,很大一部分接受抗CD19 CAR-T細(xì)胞療法的患者出現(xiàn)癌癥復(fù)發(fā)的原因是腫瘤細(xì)胞丟失了CD19抗原的表達(dá)。因此,設(shè)計(jì)能夠識(shí)別在腫瘤細(xì)胞上表達(dá)的多種抗原的CAR-T系統(tǒng)可能讓CAR-T細(xì)胞的功能更為全面,防止因?yàn)榭乖瓉G失導(dǎo)致的癌癥復(fù)發(fā)。
通過注入兩種靶向不同腫瘤抗原的CAR-T療法,或者在同一T細(xì)胞上表達(dá)兩種不同CAR,可以實(shí)現(xiàn)同時(shí)識(shí)別腫瘤上的兩種抗原。而新的研究方向是在一個(gè)CAR的細(xì)胞外蛋白域中納入兩個(gè)靶向不同抗原的scFvs,生成一個(gè)雙特異性CAR。例如,靶向CD19和CD20的雙特異性CAR已經(jīng)在動(dòng)物試驗(yàn)中防止CD19陰性的腫瘤復(fù)發(fā)。而靶向CD19和CD22的雙特異性CAR-T療法也表現(xiàn)出良好的臨床前活性。
使用藥物調(diào)控CAR-T細(xì)胞的活性
目前,在將CAR-T細(xì)胞輸回患者體內(nèi)后,如何調(diào)控免疫反應(yīng)的強(qiáng)度是一個(gè)難題。例如,與CAR-T療法相關(guān)的嚴(yán)重副作用包括細(xì)胞因子釋放綜合征和神經(jīng)毒性。這些毒副作用產(chǎn)生的原因是,將CAR-T細(xì)胞輸回患者體內(nèi)后,我們?nèi)狈τ行У氖侄蝸砜刂艭AR-T細(xì)胞的增殖、活性和在體內(nèi)的分布。
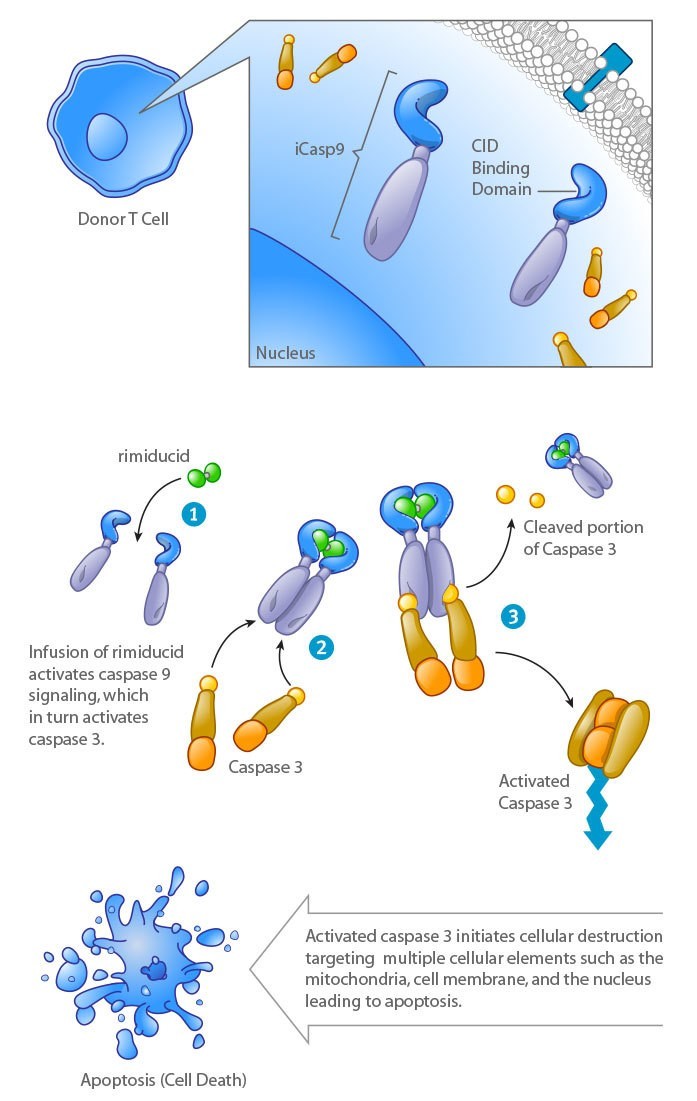
▲利用小分子藥物激活胱天蛋白酶9,導(dǎo)致CAR-T細(xì)胞凋亡的”安全開關(guān)“(圖片來源:Bellicum Pharmaceuticals公司)
為了更地控制CAR-T細(xì)胞的數(shù)量和活性,研究人員已經(jīng)開發(fā)出能夠促發(fā)CAR-T細(xì)胞“zi殺”的安全開關(guān)。以Bellicum Pharmaceuticals公司開發(fā)的CaspaCIDe技術(shù)為例,研究人員在CAR-T細(xì)胞中加入了一個(gè)能夠被名為rimiducid的小分子藥物激活的胱天蛋白酶9(Caspase 9)融合蛋白。激活胱天蛋白酶9能夠?qū)е翪AR-T細(xì)胞發(fā)生細(xì)胞凋亡,從而終止過度的CAR-T細(xì)胞活性。這一安全系統(tǒng)已經(jīng)被納入該公司的主打通用型T細(xì)胞產(chǎn)品rivogenlecleucel中。在人體試驗(yàn)中,它能夠在注入藥物30分鐘之內(nèi)就啟動(dòng)細(xì)胞凋亡。
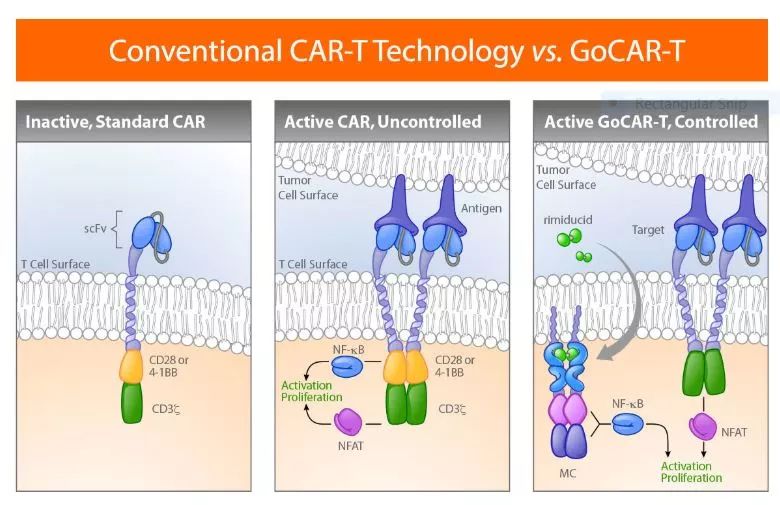
▲GoCAR-T技術(shù)讓CAR-T細(xì)胞只有在小分子藥物存在時(shí)才會(huì)被激活(圖片來源:Bellicum公司)
而另一種通過藥物來對(duì)CAR-T細(xì)胞活性進(jìn)行微調(diào)的設(shè)計(jì)方式是,讓CAR的初狀態(tài)處于未激活狀態(tài),只有在抗原和其它調(diào)控藥物存在的情況下才能夠被激活。Bellicum公司的GoCAR-T技術(shù)讓CAR的共刺激受體部分受到rimiducid的調(diào)控,只有在CAR-T細(xì)胞與腫瘤抗原蛋白接觸,并且接受rimiducid治療時(shí),CAR-T細(xì)胞才能夠被激活。該公司目前將這一技術(shù)用于治療實(shí)體瘤的CAR-T產(chǎn)品BPX-601中,目前它已經(jīng)進(jìn)入臨床期開發(fā),在1/2期臨床試驗(yàn)中接受檢驗(yàn)。

▲用小分子藥物連接分成兩半的CAR,激活CAR-T細(xì)胞(圖片來源:參考資料[6])
而上面提到過的UCSF的Wendell Lim博士的研究團(tuán)隊(duì)采用另外一種設(shè)計(jì)用藥物激活CAR-T細(xì)胞活性。他們將傳統(tǒng)的嵌合抗原受體分為兩個(gè)部分,只有在這兩個(gè)部分被藥物連接起來后,CAR才能夠激活下游信號(hào)通路,引起免疫反應(yīng)。
克服腫瘤免疫抑制微環(huán)境的障礙
CAR-T療法治療實(shí)體瘤需要克服的一個(gè)重要挑戰(zhàn)是腫瘤微環(huán)境介導(dǎo)的免疫抑制。它可能抑制T細(xì)胞的運(yùn)輸和激活,導(dǎo)致雖然CAR-T細(xì)胞能夠識(shí)別腫瘤抗原,但是仍然不能夠有效行使它的免疫功能。解決這一挑戰(zhàn)的策略之一是為CAR-T細(xì)胞武裝上新的“武器”,例如讓它們表達(dá)免疫刺激因子IL-12,IL-15或者CD40L。
例如,MSKCC的Renier J. Brentjens博士率領(lǐng)的研究團(tuán)隊(duì)通過讓CAR-T細(xì)胞持續(xù)表達(dá)IL-12,在動(dòng)物試驗(yàn)中讓這些“武裝”起來的CAR-T細(xì)胞能夠克服腫瘤微環(huán)境的抑制作用。這一團(tuán)隊(duì)還設(shè)計(jì)出表達(dá)抗PD-1抗體的CAR-T細(xì)胞,消除免疫檢查點(diǎn)蛋白對(duì)CAR-T細(xì)胞的抑制。

▲synNotch控制的表達(dá)系統(tǒng)可用來在腫瘤附近表達(dá)治療性蛋白(圖片來源:參考資料[7])
然而,讓CAR-T細(xì)胞持續(xù)表達(dá)IL-12等促炎癥細(xì)胞因子可能帶來全身性的毒副作用,因?yàn)樵谌硌h(huán)中流動(dòng)的CAR-T細(xì)胞可以不斷釋放IL-12。為了對(duì)IL-12的釋放進(jìn)行調(diào)控,UCSF的Wendell Lim博士設(shè)計(jì)出了使用synNotch控制的治療系統(tǒng),通過synNotch來在腫瘤微環(huán)境中特異性釋放IL-12等細(xì)胞因子,或者其它治療性蛋白。這些手段都可以納入CAR-T細(xì)胞的設(shè)計(jì)中,進(jìn)一步增強(qiáng)CAR-T細(xì)胞克服腫瘤微環(huán)境的能力。
結(jié)語
合成生物學(xué)已經(jīng)可以通過為CAR-T療法增添基因回路,擴(kuò)展療法的可控性和適應(yīng)能力。我們?nèi)匀恍枰嗟脑囼?yàn)來證明這些新設(shè)計(jì)在臨床情況下的效果和安全性。盧冠達(dá)博士在綜述中同時(shí)指出,這些基因回路的復(fù)雜性意味著,將它們導(dǎo)入細(xì)胞并且整合入基因組將成為研發(fā)過程的瓶頸。我們需要更精簡的基因回路設(shè)計(jì)和更有效的遞送載體。
合成生物學(xué)在癌癥治療方面的應(yīng)用仍然處于初級(jí)階段,我們期待更多的基礎(chǔ)科學(xué)、轉(zhuǎn)化科學(xué)和臨床研究讓基于基因回路的細(xì)胞療法在臨床醫(yī)藥開發(fā)方面展現(xiàn)它的威力。
參考資料:
[1] Wu et al., (2019). Engineering advanced cancer therapies with synthetic biology. Nature Reviews Cancer,
[2] A suicide switch for CAR-T? Retrieved April 15, 2019,
[3] Bellicum Pharmaceuticals. Retrieved April 15, 2019,
[4] Cellectis. Retrieved April 15, 2019,
[5] Controlling CAR-T: How scientists plan to make the engineered T cell therapy safer, and work for more cancers. Retrieved April 15, 2019,
[6] Wu et al., (2015). Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science, doi: 10.1126/science.aab4077
[7] Roybal et al., (2016). Engineering T Cells with Customized Therapeutic Response Programs Using Synthetic Notch Receptors. Cell,